氢气分子在大多数情况下是比较稳定的,但是氢原子在高温时则显现出强还原性特征。它不仅能与元素周期表中除惰性气体外的几乎所有元素反应生成氢化物,还能与金属化合物发生反应,在条件合适时,氢还能与有机物发生反应。
这一切都是由氢的特殊化学性质决定的。
氢不同于其它所有的元素,它的原子核里只有一个质子,与之相对应的,氢的原子核外也仅有一个电子。如果氢失去电子,氢就变成H⁺,事实上它就是一个带正电的质子。氢能与几乎所有呈电负性的元素形成化合物,比如在与氟(F)、氯(Cl)、溴(Br)、碘(I)等卤素元素组成化合物时,氢呈现部分正电荷;而当氢与氟(F)、氧(O)或氮(N)结合时,氢可以以一种中等强度的非共价键的形式与其他类似分子的氢结合,这种现象就是我们常说的氢键。
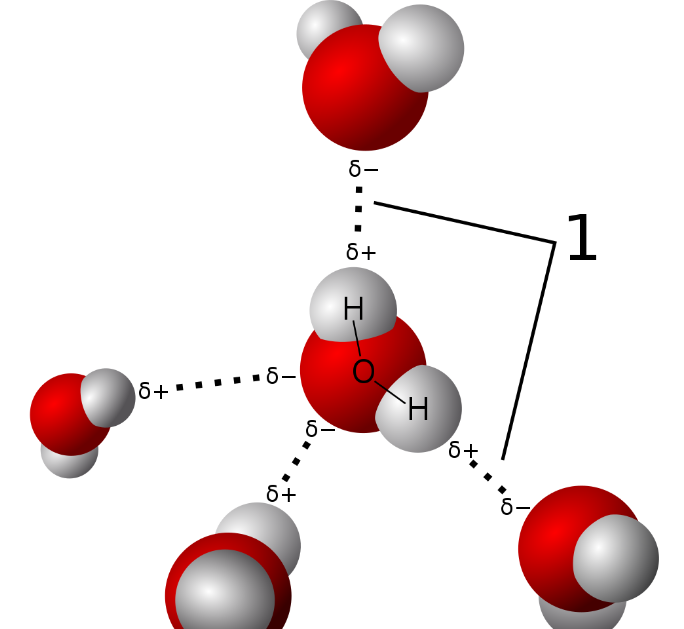
氢与氟(F)、氧(O)、氮(N)结合时形成的氢键是相应化合物拥有许多独特物理和化学特性的重要原因。
氢也能与金属和准金属形成具有较少电负性元素的化合物,在这些化合物中氢带部分负电荷。这些化合物通常被称为氢化物。
科学家们发现,元素周期表中除了He,Ne,Ar,Kr,Pm,Os,Ir,Rn,Fr和Ra之外,几乎所有元素都能与氢反应形成各种氢化物。这些氢化物通常又被分为离子氢化物(具有显著的离子键合特性)、共价氢化物(包括烃和许多其他与氢原子共价键合的化合物)和具有金属键合的间隙氢化物。




